化氢HF、HCl、 HBr、HI分子极性由强到弱的顺序();分子间取向力由强到弱的顺序为();分子间色散力由强到弱的顺序为();沸点由高到低的顺序为()。
第1题:
第2题:
第3题:
A、HF
B、HCl
C、HBr
D、HI
第4题:
烯烃与卤化氢进行加成反应时,卤化氢的活泼顺序为()。
第5题:
第6题:
 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。第7题:
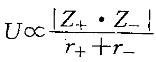 ,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。
,故MgO的熔点大于CaO的熔点。从色散力判断:HI>HBr>Ha>HF,但由于HF分子之间存在分子间氢键,其熔点较HI高。故应选择B。第8题:
A.HI、HBr、HCl、HF
B.HF、HCl、HBr、HI
C.HBr、HCl、HF、HI
D.HCl、HF、HI、HBr
第9题:
第10题:
实验室不宜用浓H2SO4与金属卤化物制备HX气体的有()。