某元素电子排布式为1s22s22p63s23p64s1,该元素原子序数为(),此元素符号为()。
第1题:
第2题:
某元素原子的核外电子排布为1S22S22P63S1,该元素的原子序数为l1,核内质子数为11 ,元素符号为( )
第3题:
第4题:
已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
第5题:
第6题:
第7题:

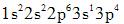


第8题:
第9题:

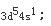

第10题:
当n=4时,该电子层电子的最大容量为()个;某元素原子在n=4的电子层上只有2个电子,在次外层l=2的轨道中有10个电子,该元素符号是(),位于周期表中第四周期,第()族,其核外电子排布式为()。