活化能大的化学反应相比于活化能小的反应,其反应速率常数对温度的变化更敏感。
第1题:
对两个活化能不同的反应,当温度同样从T1升至T2时,具有活化能高的反应,其反应速率增加的倍数比活化能低的反应增加的倍数。
A、小
B、大
C、一样
第2题:
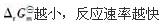


第3题:
A、质量作用定律适用于任何化学反应。
B、反应速率常数取决于反应温度,与反应物的浓度无关。
C、反应活化能越大,反应速率也越大。
D、要加热才能进行的反应一定是吸热反应。
第4题:
化学反应的活化能愈大,下列什么因素对化学反应速率的影响较大()
第5题:
对于活化能越大的反应,速率常数随温度变化越()。
第6题:
有关反应速率的叙述中错误的是( )。
A.绝大多数反应的反应速率随温度升高而增大
B.活化能大的反应速率也大
C.速率常数大的反应速率大
D.对于相同温度下的不同的反应,活化能越大,速率常数随温度的变化率越大
第7题:
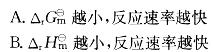
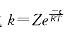 可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。
可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。第8题:
反应的活化能是什么?它是怎样影响化学反应速率的?为什么有些反应的活化能很接近,反应速率却相差很大、但有些反应的活化能相差较大,反应速率却很接近?
答案:反应的活化能是指化学反应中,由反应物分子到达活化分子所需的最小能量。
化学反应速率与其活化能的大小密切相关。活化能越低,反应速率越快,因此降低活化能会有效地促进反应的进行。
从碰撞理论给出的公式k=Ae-Ea/RT 可以看出,Ea以指数关系影响速率常数k值,它的确是影响反应速率的重要因素,但A也影响k值。对不同的反应,A对k的影响很大,所以活化能不是决定反应速率的唯一因素。
第9题:
有关反应速率的叙述中错误的是()。
第10题:
对一给定的化学反应,在一定温度下,活化能越小,反应速率();ΔrGΘm越小,平衡常数()。