某原子的原子序数是16,其电子构型为(),在周期表中位于第()周期()族。
第1题:
 族_______;
族_______;
 族_______。
族_______。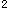 4s
4s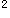 Te:5s
Te:5s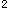 5p
5p
第2题:
某元素位于周期表中36号元素之前,该元素失去2个电子以后,在角量子数l=2的轨道上正好半充满,试回答: 该元素的原子序数,符号,所处周期和族。
第3题:
原子核外电子层结构为3d64S2的原子序数是,该元素位于周期表第周期,第族。
A、25,3,VIII
B、25,4,VIIA
C、26,4,VIIA
D、26,4,VIII
第4题:
M2+离子的3d轨道半充满的元素的原子序数为(),其价层电子构型为(),属于()周期,()族。
第5题:
当n=4时,该电子层电子的最大容量为()个;某元素原子在n=4的电子层上只有2个电子,在次外层l=2的轨道中有10个电子,该元素符号是(),位于周期表中第四周期,第()族,其核外电子排布式为()。
第6题:
第7题:
已知某元素的价电子构型为3d64s2,则其原子序数为()
第8题:
第9题:
某元素的基态价层电子构型为5d66s2,请给出比该元素的原子序数小4的元素的基态原子电子组态。
第10题:
元素在元素周期表中排列的顺序称为()