不用查表,判断下列各组中原子或离子半径谁大?试解释之。 (1)H与N(2)Ba与Sr(3)Cu与Ni(4)Na与Al(5)Fe2+与Fe3+
第1题:
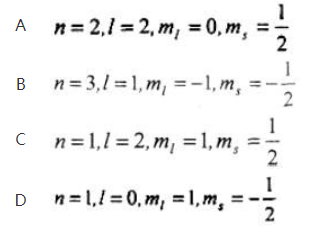

第2题:
下列各组原子或离子半径大小顺序,其中错误的是()。
第3题:
此题为判断题(对,错)。
第4题:
试解释下列各组酸强度的变化顺序。HNO3﹥HNO2
第5题:
试解释下列各组酸强度的变化顺序。HI﹥HBr﹥HCl﹥HF
第6题:
类质同象中,决定对角线法则的最主要因素是:()
第7题:
同一元素其阴离子半径()原子半径.阳离子半径()原子半径
第8题:


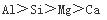
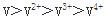
第9题:
下列原子或离子半径按递减顺序排列的是()
第10题:
试解释下列各组酸强度的变化顺序。HIO4﹥H5IO6