已知在酸性介质中,φΘMnO2/Mn2+=1.23V,在[Mn2+]=1.0mol.L-1,PH=6时,φ(MnO2/Mn2+)等于()V.
第1题:
炼钢过程中,锰与溶于金属中的氧作用表达式为()。
A、[Mn]+[O]=(MnO)
B、[Mn]+(1/2){O2}=(MnO)
C、[Mn]+(FeO)=(MnO)+[Fe]
D、3[Mn]+(Cr2O3)=3(MnO)+2[Cr]
第2题:
A.su
B.suroot
C.su-root
D.su-c"root"
第3题:
A、MnO4-与Fe2+
B、MnO4-与Fe3+
C、Mn2+与Fe2
D、Mn2+与Fe3+
第4题:
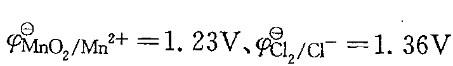 ,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
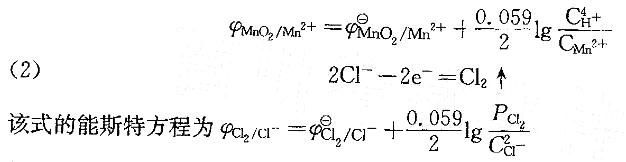
第5题:
第6题:
A . Mn2+;
B . MnO2;
C . MnO42-
第7题:
KMnO4在酸性溶液中与还原剂作用,本身被还原成( )
A.Mn2+
B.MnO2
C.Mn
第8题:
以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Φθ(MnO4-/Mn2+)Φθ(Fe3+/Fe2+),则反应物是MnO4-与Fe2+。()
第9题:
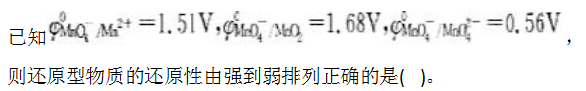
第10题:
在酸性介质中MnO4-的还原产物是()