采样前应根据水质检测目的和任务制定采样计划,包括采样目的、采样地点、采样时间、检测指标、采样方法、采样频率、采样数量、采样体积、采样容器、样品标签、现场测定项目、样品保存方法、运输工具和条件及质量控制等。水样采集、运输、保存应遵循GB/T5750.2-2006规定。
1.水样采集
(1)采样前准备:根据待测组分的特性选择适宜材质的盛水容器和采样器,并清洗干净。根据水样测定项目的要求来确定清洗容器的方法。
采样容器的选择应遵循以下原则:①容器的材质化学稳定性强,不与水中组分发生反应,如玻璃与氟化物可发生反应,故测氟时,水样不能贮于玻璃瓶中;②容器壁不吸收或吸附待测组分,一般的玻璃容器吸附金属,聚乙烯等塑料吸附有机物质、磷酸盐和油类,在选择容器材质时应予以考虑;③采样容器可适应环境温度的变化,抗震性能强;④大小适宜,便于清洗,封口严密,并容易打开;⑤尽量选用细口容器,盖和塞的材料应与容器一致。在特殊情况下需用橡胶塞或软木塞时,应用稳定的金属箔或聚乙烯薄膜包裹,最好有蜡封。有机物和某些微生物检测用的容器不能用橡胶塞,碱性样品不能用玻璃塞;⑥测定无机物、金属和放射性元素的水样应使用有机材质的采样容器,如聚乙烯、聚四氟乙烯等塑料容器;⑦测定有机物和微生物学指标应采用玻璃容器;⑧特殊项目测定的水样可采用其他化学惰性材料材质的容器,如生物(含藻类)样品应选用不透明的非活性玻璃容器,并存放暗处,光敏物质应选用棕色或深色容器。
采样容器的洗涤应遵循以下原则:①测定一般理化指标时,用洗涤剂除去灰尘、油垢后,用自来水冲洗干净,然后用10%的硝酸(或盐酸)浸泡8h,再依次用自来水和蒸馏水充分淋洗干净;②测定有机物指标时,用重铬酸钾洗液浸泡24h,然后用自来水、蒸馏水淋洗干净,置烘箱内,180℃,4h,冷却后再用纯化过的己烷、石油醚冲洗数次;③测定微生物学指标时,第一步清洗,用洗涤剂清洗后,用自来水冲洗干净,再用10%盐酸溶液浸泡过夜,依次用自来水、蒸馏水洗净;第二步灭菌,干热灭菌,160C,2h或高压蒸气灭菌,120℃,15min。高压灭菌后的容器如不立即使用,应于60℃将瓶内冷凝水烘干。灭菌后的容器应在2周内使用。
(2)水样采集:饮用水卫生调查中采集水样的主要类型主要有:水源水(地面水、地下水)、出厂水、管网水(管网及管网末梢)。水样采集的重要原则是样品具有代表性,能反映所调查水体或供水管网的水质状况。
1)一般要求:同一水源、同一时间采集几类检测指标水样时,应分类采集、分类保存。首先应采集供微生物指标检测的水样。采样时应直接采集,不得用水样刷洗已灭菌的采样瓶,不得将水样充满采样瓶(约2/3体积),并避免手指和其他物品对瓶口的沾污,同时应注意整个采样过程的无菌操作。采集供理化检测的水样时,采样前应用水样荡洗采样器、采样容器和塞子2~3次(油类除外)。
采样时应注意:①采样时不可搅动水底的沉积物;②采集测定油类的水样时,不能用水样冲洗采样瓶(器),同时应在水面至水面下300mm采集柱状水样,水样充满采样瓶,全部用于测定;③采集测定溶解氧、生化需氧量和有机物的水样时,应将水样注满容器,上部不留空间,并采用水封;④含有可沉降性固体(如泥沙等)的水样,应分离除去沉淀物。分离方法为:将所采水样摇匀后倒入筒形玻璃容器(如量筒),静置30min,对已不含沉淀性固体但含有测定悬浮物和水中所含组分的水样,应在现场将水样经0.45μm膜过滤后,分别加入固定剂保存;⑤测定油类、BODs、硫化物、微生物、放射性等项目要单独采样;⑥完成现场测定的水样不能带回实验室供其他指标测定使用。
2)水源水的采集:水源水的采集通常应选择汲水处,主要有下列几类水样:河流、湖?白、水库等表层水和一定深度的水,如泉水和井水等。样品采集时应注意不能混入水面上的漂浮物。表层水、自涌泉等可以直接采集,可用适当的容器如水桶采样;一定深度的水可用直立式采水器;非自涌泉水和深井水应在充分抽汲后进行采样,以保证水样代表性。
a.河水样品的采集:应根据河流大小按表2-22及表2-23要求采样。

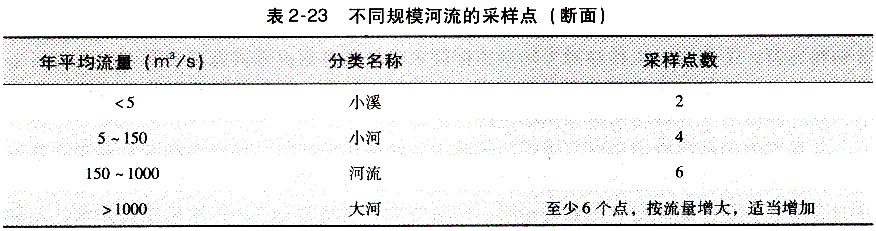
注:离岸边有一定的距离,在河底上采样时不要搅动底层
河流采样断面的设置:河流的水体自净能力较强,对于河流尤其对较大的河流应考察其水质在流经某一段距离后的水质变化情况,一般设置多个断面,即:对照断面、污染断面、自净断面、监控断面等。实际工作中可根据具体情况进行调整。
对照断面:设在污染源的上游,以了解河流未受本地区污染时的水质状况。
污染断面:设在污染源的下游,以了解特定排污对于水体的影响,同时评价水质污染状况和程度。
自净断面:设在污染断面下游一段距离,以了解污染范围及河水的自净能力。
监控断面:为了解城乡生活饮用水水源取水点水质状况,指导水质处理,确保供水水质,在集中式供水取水点河段设置的断面。
b.湖泊、水库水样品的采集:湖泊、水库水并不是均匀混合的,经常发生水平和垂直的梯度变化,常随季节和当地天气情况而有所变化。采样时应考虑其自身特点,可按不同水区设置监测断面,如进水区、出水区、深水区、浅水区、湖心区、污染源废水排入区等设置采样点,同时以远离污染的清洁区水样作对照。由于湖(库)水流动缓慢,沉淀作用较强,对水体底质和生物的监测更有意义。此外,湖泊水库的富营养化问题日益严重,因而对湖水监测时应增加磷、氮及藻类毒素的测定。为了保证采样点的选择符合要求,必须先收集有关的资料,以制定出采样的详细规划。
c.地下水样品的采集:地下水可分为浅层地下水(又称潜水)、深层地下水(包括承压水和非承压水)和泉水(包括潜水泉和自流泉)。浅层地下水主要由降水经土壤地层渗透而形成,有时也由地面水体补给。
隔水层被破坏、井壁渗漏或污水渗入深井,可使深层地下水遭到污染;地下水大量被开采,使易污染和已污染的浅层水与深层含水层沟通;化肥农药及各种污染物经渗透而迁移至地下水层;地下污水管道破裂以及污水回灌、油井及矿山开采等均可导致地下水污染。受污染的地表水、生活垃圾堆放场渗出液、灌溉农田污水等均可透过土壤表层渗入地下水。
由于地下结构十分复杂,因此地下水污染的调查与监测点的设置常受到限制。自监测井采集的水样只代表含水层平行和垂直的一小部分。所以,进行现场采样前,应合理地确定采样位置。浅层地下水的监测点应包括目标井及其周围30m范围内的井及河流等;深层地下水和泉水的采样点结合当地水文、地质情况在其可能补给水源范围内的井及河流进行布点。
3)出厂水的采集:出厂水是指集中式供水单位水处理工艺过程完成的水,采样点应设在水出厂进入输配水管网前。监测点设于集中式供水单位的出水口处,采样点数与水厂出水口的数量一致。
4)管网水的采集:管网水是指出厂水经输配水管网输送到用户的水(龙头水),包括管网末梢水(城市供水管网的末端区域)。样品采集时应考虑供水范围,采样点布置应与供水半径对应。同时应注意采样时间,夜间可能析出管道附着物质,早晨取样,悬浮物及一些组分的含量较高,应开启水龙头,放水数分钟后再取样。需要注意的是,在水样中的钙、镁、铁和重碳酸盐共存时,在放置过程中组分将发生改变,如铁盐(未加酸保存)可能析出黄色氧化铁沉淀;钙、镁可能生成白色碳酸盐沉淀等。因此,在采集管网系统的水样前,必须放水15min以上,使管道冲洗充分,以保证水样的代表性。采集用于微生物学指标的样品前应对水龙头进行消毒。参考表2-24进行采样点的设置。

管网本身的腐蚀可污染水质;管网布设穿过垃圾、有毒有害物污染区域或与污水管道、排污沟距离太近;或因施工、承受重力、地壳变动等引起管网出现折裂;水压不足、缺水、断水等形成管网内负压等均可造成对水质的污染。
5)二次供水的采集:二次供水是指集中式供水在入户之前经再度储存、加压、消毒或深度处理,通过管道或容器输送给用户的供水方式。样品的采集应包括上述处理前进水、处理后出水及入户龙头水。参考表2-25进行采样点的设置。

如果二次供水设施的设计和建造不合理;施工原材料、涂料及用于清洗消毒的器具、药剂等的污染;供、管水人员和清洗消毒人员是病毒性肝炎、痢疾、伤寒等疾病患者和病菌携带者;工作中造成污染及二次供水卫生管理不当等,均可造成污染。
6)分散式供水的采集:分散式供水是指用户直接从水源取水,包括河水、溪水、湖水、水库水、水窖水、沟塘水、井水等。采样方法参考水源水,采样范围较小。
(3)采样体积:根据测定指标、检测方法、平行样检测所需样品量等情况计算并确定采样体积。为避免样品在运输途中的振荡,以及空气中的O
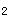
、CO
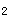
对容器内样品组分和待测项目的干扰,应使水样充满容器至溢流并密封保存。但对准备冷冻保存的样品不能充满容器,否则水冻冰之后,因体积膨胀致使容器破裂。样品采集时,应分类采集,参见表2-26。

2.水样保存 检测指标不同,检测方法就不同,其保存方法也不同。水样保存的要求:抑制微生物作用;减缓化合物或配合物的水解、解离及氧化还原作用;减少组分的挥发和吸附损失。
水样采集后尽快测定各项指标:①水温、pH、游离余氯、浊度、色度、溶解氧(DO)等指标在现场测定;②亚硝酸盐氮、六价铬、苯并(a)芘要尽快测定;③卤代烃类、微生.物在4h内测定;④BOD
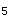
、挥发性有机物、微生物在12h内测定;⑤Br、I

在14h内测定;⑥COD、氨氮、硝酸盐氮、氰化物、挥发酚类、农药类、除草剂类等在24h内测定;⑦其余指标最好于7天内测定。BOD
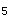
、F、Cl、Br、I

、SO

、氨氮、亚硝酸盐氮、硝酸盐氮、氰化物、挥发酚类、卤代烃类、苯并(a)芘、农药类、除草剂类、邻苯二甲酸酯类、挥发性有机物、甲醛、乙醛、丙烯醛、微生物、生物等应低温(0~4.℃)避光保存。
根据测定指标选择适宜的保存方法,主要有冷藏、加入保存剂等,一般水样在4℃冷藏保存,贮存于暗处;保存剂不能干扰待测物的测定,其纯度和登记应达到分析的要求;保存剂可预先加入采样容器中,也可在采样后立即加入,但是易变质的保存剂不能预先添加;水样的保存期限主要取决于待测物的浓度、化学组成和物理化学性质。
3.样品管理与运输
(1)样品管理:除用于现场测定的样品外,大部分水样都要运回实验室进行分析,在水样运输和实验室检测过程中应保证其性质稳定、完善、不受沾染、损坏和丢失。采集的水样应有采样标签和采样记录,注明水样编号、采样者、采样日期、采样时间、采样地点、水样体积、数量、保存方法、水样采集点周边状况、气温、水温、需检测指标等信息。
(2)样品运输:样品装箱运输前应逐一核对样品标签、采样记录、检查容器是否盖好或封好,用于检测油类的水样不能用蜡封;按照冷藏、保温、常温等分类装箱,做好防震、防碰撞等衬垫工作等。夏季应注意运输时间不宜过长,同时注意防止样品温度过高,导致水中化学物质发生反应,尤其应注意微生物学监测水样的保存条件;冬天应避免水样在运输过程中结冰,影啊检测结果。
4.水样采集的质量控制 为使水样能真实反应受检体的水质状况,必须做好好采样过程的质量控制,防止水样在采集过程中受到污染或发生变质。
(1)现场空白:在采样现场以纯水作样品按照测定项目的采样方法和要求,与样品相同条件下装瓶、保存、运输直至送交实验室分析。通过将现场空白与实验室内空白测定结果相对照,了解采样过程中操作步骤和环境条件对样品质量的影响。
(2)运输空白:以纯水作样品,从实验室带到采样现场又返回实验室。运输空白可用来测定样品运输、现场处理和贮存期间或由容器带来的可能沾污。每批样品至少有一个运输空白。
(3)现场平行样:在同等采样条件下,采集平行样送回实验室分析,测定结果可反映采样和实验室泓定的精密度。当实验室精密度受控时,主要反映采样过程的精密度变化。现场平行样要注意控制采样操作和条件的一致,对水质中非均相物质或分布不均匀的污染物,在样品灌装时摇动采样器,使样品保持均匀。现场平行采样占样品总量的10%以上,一般每批样品至少采集两组平行样。
(4)现场加标样或质控样:现场加标样或质控样的数量,一般控制在样品总量的10%左右,每批样品不少于2个。
1),现场加标样:取一组现场平行样,将实验室配置的一定浓度的被测物质的标准溶液等量加入到其中一份已知体积的水样中,另一份不加标样,然后按样品要求处理,送实验室分析。将测定结果与实验室加标样对比,掌握测定对象在采样、运输过程中的准确度变化情况。现场加标除加标在采样现场进行外,其他要求应与实验室加标样相一致,并使用统一标准溶液。
2)现场质控样:将标准样与样品基本组分接近的标准控制样带到采样现场,按样品要求处理后与样品一起送回实验室分析。
5.水样的现场检测 部分水质指标易受水中化学成分的变化而发生改变,因此,应在水质采集现场进行测定,以确保水质监测结果的真实性,如:pH、余氯等。
(1)pH:可选用玻璃电极法或标准缓冲液比色法(目测比色法)进行检测。
1)玻璃电极法:pH是水中氢离子活度倒数的对数值,用玻璃电极法检测可精确到0.01。
2)标准缓冲液比色法(目测比色法):本法适用于色度和浑浊度较低的水样pH的测定,可准确到0.1。色度、浑浊度、较高游离氯、氧化剂、还原剂等均干扰测定。
(2)余氯(游离余氯、总余氯、化合余氯):为保证饮用水的安全卫生,在出厂水、管网水、末梢水中均保留一定量的余氯,以杀灭供水过程中受到的少量微生物污染。游离余氯是微生物学安全性的指示性指标。由于游离余氯易挥发,因此,应在水样采集现场进行测定。常用的现场检测方法为3.3',5.5'-四甲基联苯胺比色法,其最低检测浓度为0.005mg/L,超过0.12mg/L的铁和0.05mg/L的亚硝酸盐会干扰测定。






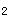 、CO
、CO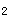 对容器内样品组分和待测项目的干扰,应使水样充满容器至溢流并密封保存。但对准备冷冻保存的样品不能充满容器,否则水冻冰之后,因体积膨胀致使容器破裂。样品采集时,应分类采集,参见表2-26。
对容器内样品组分和待测项目的干扰,应使水样充满容器至溢流并密封保存。但对准备冷冻保存的样品不能充满容器,否则水冻冰之后,因体积膨胀致使容器破裂。样品采集时,应分类采集,参见表2-26。

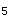 、挥发性有机物、微生物在12h内测定;⑤Br、I
、挥发性有机物、微生物在12h内测定;⑤Br、I 在14h内测定;⑥COD、氨氮、硝酸盐氮、氰化物、挥发酚类、农药类、除草剂类等在24h内测定;⑦其余指标最好于7天内测定。BOD
在14h内测定;⑥COD、氨氮、硝酸盐氮、氰化物、挥发酚类、农药类、除草剂类等在24h内测定;⑦其余指标最好于7天内测定。BOD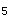 、F、Cl、Br、I
、F、Cl、Br、I 、SO
、SO 、氨氮、亚硝酸盐氮、硝酸盐氮、氰化物、挥发酚类、卤代烃类、苯并(a)芘、农药类、除草剂类、邻苯二甲酸酯类、挥发性有机物、甲醛、乙醛、丙烯醛、微生物、生物等应低温(0~4.℃)避光保存。
、氨氮、亚硝酸盐氮、硝酸盐氮、氰化物、挥发酚类、卤代烃类、苯并(a)芘、农药类、除草剂类、邻苯二甲酸酯类、挥发性有机物、甲醛、乙醛、丙烯醛、微生物、生物等应低温(0~4.℃)避光保存。