将0.2mol/L的醋酸与0.2mol/L醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为(Ka=1.76×10-5)()
第1题:
A、0.5mol•L-1HCl和0.5mol•L-1NaAc
B、0.1mol•L-1HCl和 0.2mol•L-1NaAc
C、0.2mol•L-1HCl和0.1mol•L-1NaAc
D、HCl和NaAc无论浓度体积怎么样变化都不能组成缓冲溶液
第2题:
 。
。第3题:
下列溶液中渗透压最大的是()
A、C(NaCl)=0.2mol/L
B、C(C6H12O6)=0.2mol/L
C、C(CaCl2)=0.2mol/L
D、C(1/2NaCl)=0.2mol/L
E、C(NaHCO3)=0.2mol/L
第4题:
使0.2mol·L-1HNO3溶液100mL的pH值增加到7,需加入固体NaOH()克,使0.2mol·L-1HAc溶液100mL的pH值增加到7需加入固体NaOH比上述硝酸要()(多,少或相等)
第5题:
双硫腙分光光度法测定铅,如果选用单色法,去除双硫腙的洗脱液应是()
第6题:
 ,溶液中(Br-)=2.3×10-5mol·L-1<0.2mol·L-1,故有PbBr2沉淀出现
,溶液中(Br-)=2.3×10-5mol·L-1<0.2mol·L-1,故有PbBr2沉淀出现第7题:
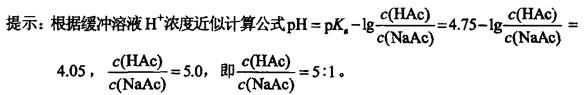
第8题:
下列混合溶液具有缓冲作用的是。
A、0.2mol·L-1的NH4Cl和0.2mol·L-1的NaOH溶液等体积混合
B、0.2mol·L-1的NH4Cl和0.1mol·L-1的NaOH溶液等体积混合
C、0.2mol·L-1的HAc和0.2mol·L-1的NaOH溶液等体积混合
D、0.2mol·L-1的NaAc和0.2mol·L-1的HCl溶液等体积混合
第9题:
求0.2mol/L H2SO4溶液的pH值。
第10题:
将0.1mol/L的NaOH溶液与0.2mol/L的HAC溶液等体积混合,混合溶液具有缓冲作用。