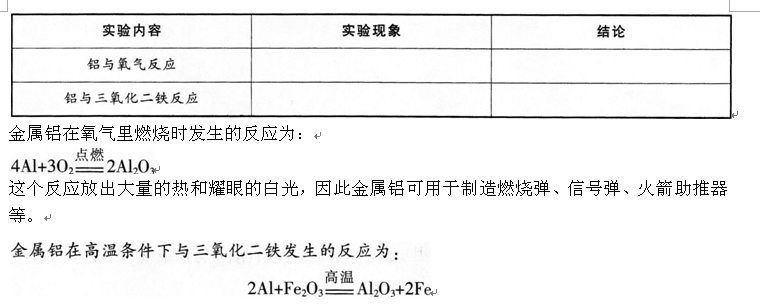
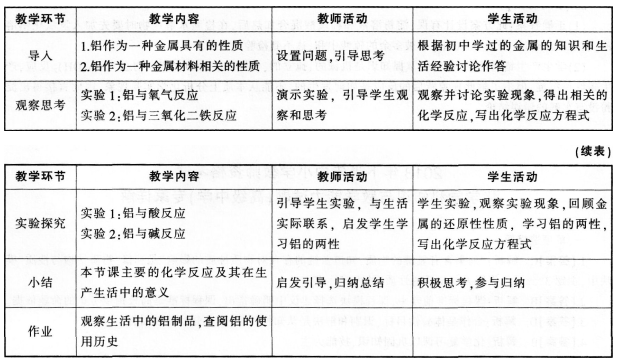
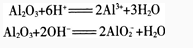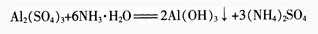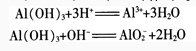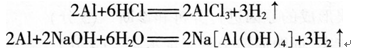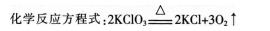阅读下列三段材料,根据要求完成任务。
材料一《普通高中化学课程标准(实验)》关于金属及其化合物的内容标准:根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。
材料二某版本高中实验教科书《化学l》“铝的重要化合物”的内容:二、铝的重要化合物
铝是地壳中含量最多的金属元素,但人们发现并制得单质铝却比较晚,这是由于铝很活泼.从铝的化合物中提炼铝单质比较困难。铝的许多化合物在人类的生产和生活中具有重要的作用。
1.氧化铝
我们已经知道,氧化铝难溶于水,熔点很高,也很坚固,因此覆盖在铝制品表面极薄的一层氧化铝就能有效地保护内层金属。氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料。
它可以用来制造耐火坩埚、耐火管和耐高温的实验仪器等。
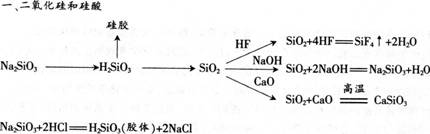
氧化铝难溶于水,却能溶于酸或强碱溶液中。它溶于碱时,生成物是偏铝酸盐和水。因此,氧化铝是一种两性氧化物。
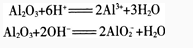
2.氢氧化铝【实验3-7】
在试管里加入l0 mL 0.5 mol/L Al2(S04)3溶液,滴加氨水,生成白色胶状物质。继续酒加氨水.直到不再产生沉淀为止。
反应中得到的白色胶状物质是氢氧化铝[AI(OH)3],它几乎不溶于水,但能凝聚水中的悬浮物.并能吸附色素。在实验室里,常常用铝盐溶液与氨水反应来制取氢氧化铝。
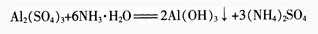
【实验3-8】
取一些上面实验中制得的AI(OH),沉淀,分装在2支试管里,往一支试管里滴加2 mol/L盐酸.往另一支试管里滴加2 mol/L NaOH溶液。边加边振荡,观察现象。
实验证明,AI(OH)3在酸或强碱溶液里都能溶解。这说明它既能与酸起反应,又能与强碱起反应.它是两性氢氧化物。
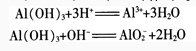
AI(OH)3是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。
加热时,AI(OH)3分解为氧化铝和水。
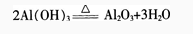
【学与问】
问题:为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,而不用氢氧化钠溶液?
材料三教学对象为高中一年级学生,他们已经学习了必修化学1的“铝单质”“物质的分类”以及“离子反应”等知识。
要求:
(1)回答材料二“学与问”中的问题。
(2)完成“铝的重要化合物’’的教学设计片段,内容包括教学目标、教学方法和教学过程。