对
错
第1题:
在Fe3++e→Fe2+电极反应中,加入Fe3+的配位剂F-,则电极电势的数值升高。()
第2题:
第3题:
A、O2(g)+4H+(aq)+4e⇋2H2O(l)
B、Fe3+(aq)+e⇋Fe2+(aq)
C、2Fe3+(aq)+Fe(s)⇋3Fe2+(aq)
D、Fe3+(aq)+3e⇋Fe(s)
第4题:
下列哪一体系可以自发发生同化反应而产生中间氧化态离子? ()
第5题:
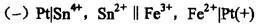 ,则此电池反应的产物为 ( )。
,则此电池反应的产物为 ( )。
第6题:
A、Fe3+较H+容易被还原
B、Fe2+较H+容易被还原
C、Fe3+较Fe2+容易被还原
D、Fe较H2容易被氧化
第7题:
第8题:
以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Φθ(MnO4-/Mn2+)Φθ(Fe3+/Fe2+),则反应物是MnO4-与Fe2+。()
第9题:
在标准条件下将氧化还原反应Fe2++Ag+Fe3++Ag装配成原电池,原电池符号为()
第10题:
下列电对中,若改变电极反应的pH值,则电对电极电势不变的是()