第1题:
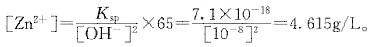
第2题:
用NH4Cl-NH3沉淀Fe(OH)3与Ca2+分离时,为使Ca2+共存沉减少,NH4Cl的浓度应当()些,NH3浓度应当()些。若与Zn2+分离,为使Zn2+共存沉小些,NH4Cl浓度应当()些,NH3浓度应当()些。(指大或小)
第3题:
A、都增加
B、都减少
C、Zn2+、Ni2+增加,而Ca2+、Mg2+减少
D、Ca2+、Mg2+增加,而Zn2+、Ni2+减少
第4题:
今在铵盐存在下,利用氨水作为沉淀剂沉淀Fe3+,若铵盐浓度固定,增大氨的浓度,Fe(OH)3沉淀对Ca2+、Mg2+、Zn2+、Ni2+等四种离子的吸附量将是()。
第5题:
用EDTA滴定Zn2+,使用缓冲溶液的目的是()。
第6题:
投石灰以去除水中的Zn2+,生成Zn(OH)2沉淀,当pH=7或10时,问溶液中Zn2+的浓度各有多少?(mg/L)
第7题:
溶液[H+]≥0.24mol/L时,不能生成硫化物沉淀的离子是()。
第8题:
A、Ca2+
B、Mg2+
C、Cu2+
D、Zn2+
第9题:
溶液中有AL3+和Zn2+时,在PH等于5.5的酸性溶液中,可用()掩蔽AL3+以滴定ZN2+。
第10题:
叶面喷Zn2+时,溶液的pH应调到()性。