变大
变小
不变
不能确定
第1题:
第2题:
 ,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。
,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。

第3题:
此题为判断题(对,错)。
第4题:
在标准条件下将氧化还原反应Fe2++Ag+Fe3++Ag装配成原电池,原电池符号为()
第5题:
当溶液中同时存在Ag+和Cl-时,产生沉淀的条件为()。
A[Ag+]>[Cl-]>KspAgCl
B[Ag+]²[Cl-]>KspAgCl
C[Ag+]²[Cl-]
第6题:
 的负极中加入NaCl,则原电池电动势的变化是:
的负极中加入NaCl,则原电池电动势的变化是:

第7题:
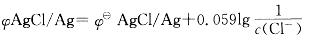
第8题:
A.[Ag+][Cl-]
B.Ksp=[Ag+][Cl-]
C.KspAgCl=[Ag+][Cl-]
D.QspAgCl=[Ag+][Cl-]
第9题:
把氧化还原反应Zn+2Ag+Zn2++2Ag组成原电池,欲使该原电池的电动势增大,可采取的措施是()
第10题:
Ag+在过量的NaCl溶液中形成沉淀,则AgCl沉淀表面的吸附层主要由()构成,扩散层主要由()构成。