FeCl3溶液能使KI淀粉试纸变蓝
FeCl3溶液中加入NaOH溶液产生红褐色沉淀
FeCl3溶液中加入AgNO3溶液产生白色沉淀
FeCl3溶液滴入沸水中产生红褐色的胶体
第1题:
下列反应中既表现了浓硫酸的酸性,又表现了浓硫酸的氧化性的是( )
A.与铜反应;
B.使铁钝化;
C.与碳反应;
D.与碱反应。
第2题:
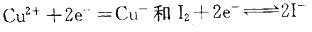 ,离子浓度升髙,它们的电极电势增加
,离子浓度升髙,它们的电极电势增加
 ,所以氧化性的强弱为MnO4- >Cr2O72-
,所以氧化性的强弱为MnO4- >Cr2O72-
 能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
 B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
第3题:
A、在卤元素离子中,除I-外均不能被Fe3+氧化;
B、卤离子中,Br-,I-均能被Fe3+氧化;
C、卤离子中,除F-外均能被Fe3+氧化;
D、Cl2能氧化Fe3+。
第4题:
合成红宝石在蓝绿区具有468、475和476nm的吸收线是由于哪一种原因造成的?()
第5题:
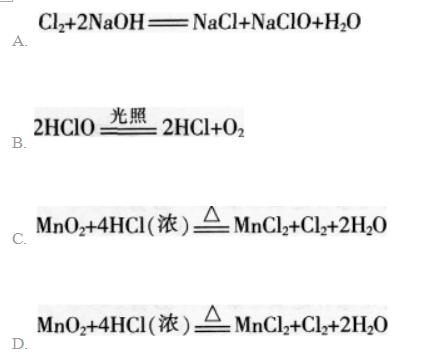

第6题:
检查铁盐时,需加入过硫酸铵固体适量的目的在于
A、消除干扰
B、加速Fe3+和SCN的反应速度
C、增加颜色深度
D、将低价态铁离子(Fe2+)氧化为高价态铁离子(Fe3+),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
E、将高价态铁离子(Fe3+)还原为低价态铁离子(Fe2+)
第7题:
第8题:
铁盐检查时,需加入过硫酸铵固体适量的目的在于( )。
A.消除干扰
B.加速Fe3+和SCN-反应速度
C.增加颜色深度
D.将低价态铁离子Fe2+氧化为高价态铁离子(Fe3+),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
E.将高价态铁离子(Fe3+)还原为低价态铁离子(Fe2+)
第9题:
第10题:
铁盐检查时,需加入过硫酸铵固体适量的目的在于()