某原电池的一个半电池是由金属银片浸在1.0mol·L-1Ag+溶液中组成的,另一半是由银片浸在C(Br-)为1.0mol·L-1的AgBr饱和溶液中组成的,后者为负极,测得电池电动势为0.728V。计算EΘ(AgBr/Ag)=(),KspΘ(AgBr)=()。
第1题:

第2题:
第3题:
此题为判断题(对,错)。
第4题:
由外界电能引起化学反应的电池称作原电池。
第5题:
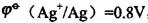 ,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。
,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。
第6题:
原电池是由两根( )插入电解质溶液中组成的。
A.金属片
B.导体
C.电极
D.碳棒
第7题:
第8题:
下列原电池符号正确的是。
A、(-)Zn|Zn2+(1.0mol·L-1)║Cu|Cu2+(1.0mol·L-1)(+)
B、(-)Zn|Zn2+(1.0mol·L-1)║Fe3+(1.0mol·L-1)|Fe2+(1.0mol·L-1)|Pt(+)
C、(-)Zn|Zn2+(1.0mol·L-1)║Fe3+(1.0mol·L-1),Fe2+(1.0mol·L-1)(+)
D、(-)Zn|Zn2+(1.0mol·L-1)║Fe3+(1.0mol·L-1),Fe2+(1.0mol·L-1)|Pt(+)
第9题:
金属原子含有电子是形成原电池腐蚀的必备条件之一。()
第10题:
关于参比电极的描述,正确的是()