关于杂化轨道理论,下列说法错误的是()。
第1题:
第2题:
根据杂化轨道理论,苯环中碳原子的结构特点是下列哪一种
A、未杂化的P轨道
B、sp2杂化
C、sp杂化
D、sp杂化和未杂化的P轨道
E、sp2杂化和未杂化的P轨道
第3题:
sp3杂化轨道是由。
A、一条ns轨道与三条np轨道杂化而成;
B、一条ls轨道与三条2p轨道杂化而成;
C、一条ls轨道与三条3p轨道杂化而成;
D、一个s电子与三个p电子杂化而成。
第4题:
杂化理论中电子激发与轨道杂化使系统能量降低的原理是一样的。
第5题:
第6题:
A.sp杂化轨道
B.sp2杂化轨道
C.sp3杂化轨道
D.孤电子杂化轨道
答案:D
解析:
杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,没有杂化的P轨道形成π键。
D强行定义,所以答案是错误的。
第7题:
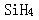
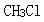
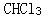
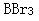
第8题:
根据轨道杂化理论,烯烃的双键是由下列哪种轨道杂化而成的
A.sp
B.Sp2
C.sp3
D.d
E.spd
第9题:




第10题:
什么是杂化和杂化轨道?杂化轨道的数目与什么有关?