在1mol/l的HAc溶液中,欲使H+浓度增大,可采取下列何种方法()?
第1题:
在1mol/L的HAc溶液中,欲使H+浓度增大,可采取下列何种方法( )。
A.加水;
B.加NaAc;
C.加NaOH;
D.加0.1mol/L HCl溶液
第2题:
钠离子交换器再生时,在一定浓度的盐液中,树脂对Na〈sup〉+〈/sup〉的吸取会优先于Ca〈sup〉2+〈/sup〉、Mg〈sup〉2+〈/sup〉。
此题为判断题(对,错)。
第3题:
A、加水
B、加NaAc
C、加0.1mol/LHCl溶液
第4题:
第5题:
第6题:
在1MOL/L的醋酸溶液中,存在着HAC <=>H++AC-的电离平衡,要使溶液中氢离子浓度增大,并且醋酸的电离度减小,可采用( )。
A.加NAOH
B.加水
C.加冰醋酸
D.加醋酸钠
第7题:
阈电位是指
A.使K<sup>+</sup>通道突然开放的临界膜电位
B.使K<sup>+</sup>通道突然关闭的临界膜电位
C.使Na<sup>+</sup>通道大量开放的临界膜电位
D.使Na<sup>+</sup>通道突然关闭的临界膜电位
E.使K<sup>+</sup>和Na<sup>+</sup>通道突然开放的临界膜电位
第8题:
用同一NaOH溶液分别滴定容积相等的H2SO4和HAC溶液,消耗的容积相等.说明H2SO4和HAC两溶液中的( )。
A.氢离子浓度(单位:mol/L下同)相等
B.H2SO4和HAC的浓度相等
C.H2SO4的浓度为HAC的浓度的1/2
D.H2SO4和HAC的电离度相等
E.两个滴定的PH突跃范围相同
第9题:
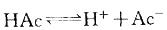 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: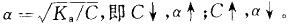 。
。第10题:
有一混合酸溶液,其中HF的浓度为1.0mol/L,HAc的浓度为0.10mol/L,求溶液中H+,F-,Ac-,HF和HAc的浓度已知:Ka(HF)=3.53×10-4 Ka(HAc)=1.76×10-5