原电池电动势是原电池两极间的()。
第1题:
已知原电池反应:Cu(s)+Cl2(g)=Cu2+(aq)+2Cl-(aq)。当增大Cl2(g)压力,原电池的电动势变_______;当增大Cu2+(aq)浓度,原电池的电动势变__________。
A、增加,减小
B、增加,增加
C、减小,增加
D、减小,减小
第2题:
 的负极中加入NaCl,则原电池电动势的变化是:
的负极中加入NaCl,则原电池电动势的变化是:

第3题:
此题为判断题(对,错)。
第4题:
原电池的正负两极都发生氧化还原反应。
第5题:
由于电流通过而引起原电池两极间电位差减少的现象,称为原电池的极化,发生极化现象时,金属腐蚀速度加快。
A对
B错
第6题:
原电池两极间的( )称为原电池的电动势。
A.电位差
B.最大电位差
C.极大电位差
D.平均电位差
第7题:
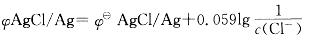
第8题:
在一定温度下,原电池的标准电动势只取决于原电池的两个极,与电池中各物质的浓度无关。()
第9题:
原电池中阴极电位变低,阳极电位变高;阴、阳两极间的电位差降低,这种电极电位的变化叫去极化。
第10题:
原电池两电极间的最大电位差叫做原电池的()。