20.00mL,0.1mol/L硫酸溶液滴定到化学计量点,需消耗0.1mol/L氢氧化钠溶液20.00mL。
第1题:
A.pH>7.0
B.pH=7.0
C.pH<7.0
D.无法确定
第2题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH是( )
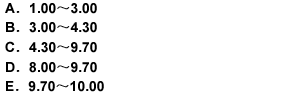
第3题:
此题为判断题(对,错)。
第4题:
计算0.1mol/L(NaOH)氢氧化钠溶液的PH值?
NaOH为强碱,全部电离
NaOH→Na++OH-
POH=-lg[OH-]=-lg(10-1)=1
PH=14-1=13
求得0.1mol/L(NaOH)氢氧化钠溶液的PH值为13。
略
第5题:
第6题:
用C(NaOH)0.1000mol/L的NaOH溶液滴定C(H2SO4)0.1000mol/LH2SO4溶液20.00ml,以甲基红为指示剂,问终点时需要消耗NaOH溶液多少毫升?
第7题:
用0.1000mol/L NaOH溶液滴定20.00ml 0.1mol/L HAC溶液,滴定终点的PH值及选择指示剂为( )。
A.PH=8.7,酚酞
B.PH=7.0,甲基红
C.PH=9.7,酚酞
D.PH=6.2,甲基红
第8题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是( )。
A.1.00~3.00
B.3.00~4.30
C.4.30~9.70
D.8.00~9.70
E.9.70~10.00
本题考查酸碱突跃的范围。强碱强酸的滴定突跃为4.30~9.70。
第9题:
第10题:
以酚酞为指示剂,中和10.00mL0.1mol/L的H3PO4溶液,需用0.1mol/L的NaOH()