若298K时反应N2O4(g)=2NO2(g)的Kq=0.1132,则当p(N2O4)=p(NO2)=100kPa时,反应将()
第1题:
1000K 时反应 Fe(s) + CO2(g) = FeO(s) + CO(g) 的 Kө=1.84,当 气相中CO2 和 CO的摩尔数之比为 65∶35时,则() AFe 不会被氧化
BFe 将被氧化
C正好达化学平衡
D难于判断其进行方向
第2题:
恒温下,在反应2NO2(g)=N2O4(g)达到平衡后的体系中加入惰性气体,则平衡不移动。()
第3题:
(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)=====N2O4(g) ΔH=-57.20 Kj·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出
19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)======3N2(g)+4H2O(l)的ΔH=
▲ kJ·mol-1。
(3)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17℃、1.01*105 Pa),理论上至少需消耗Cu多少克?

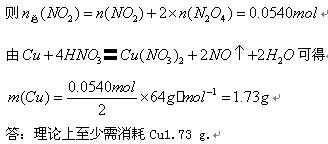
第4题:
在NO2=N2O4的可逆反应中,下列状态不是处于平衡状态的是()。
AV正=V逆≠0
BNO2全部转化为N2O4的状态
C混合物中,NO2的百分含量不再改变的状态
D体系的颜色不再发生变化
第5题:
在NO2≒N2O4的可逆反应中,下列状态不是处于平衡状态的是( )。
A.V正=V逆≠0
B.NO2全部转化为N2O4的状态
C.混合物中,NO2的百分含量不再改变的状态
D.体系的颜色不再发生变化
第6题:
若 298K 时反应N2O4 (g) = 2NO2(g) 的 Kө =0.1132,则当 N2O4 和 NO2 的分压均为1.0 kPa 时, 该反应()
A向生成 NO2 的方向进行
B向生成 N2O4 的方向进行
C正好达到化学平衡
D难于判断其进行方向
第7题:
放热反应2NO(g)+O2(g)=2NO2(g)达平衡后,若分别采取①增加压力;②减少NO2的分压;③增加O2分压能使平衡向产物方向移动。()
第8题:
A、0.24
B、0.12
C、0.41
D、0.23
第9题:
第10题:
当压力增加时化学平衡向气体分子数()的方向进行;当温度升高时化学平衡向()反应的方向移动。