下列与化学反应能量变化相关的叙述正确的是()。
第1题:
对于反应Pcl5(g)═Pcl3(g)+cl2(g),恒压条件下升高温度,会增大Pcl5的分解率。则判断该反应为______。
A、吸热反应
B、放热反应
C、无热效应反应
第2题:
第3题:
A、质量作用定律适用于任何化学反应。
B、反应速率常数取决于反应温度,与反应物的浓度无关。
C、反应活化能越大,反应速率也越大。
D、要加热才能进行的反应一定是吸热反应。
第4题:
什么是化学能?怎样判断化学反应中反应物和生成物的能量变化?
第5题:
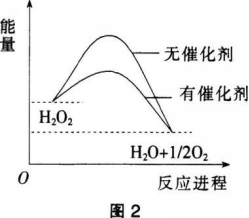
第6题:
A、升高温度无论是吸热反应还是放热反应,速率都加快,只是加快的程度不同
B、影响化学反应速率的决定性因素是反应物的种类和性质
C、在恒温恒容的条件下,能使A(g)+B(g)C(g)+D(g)反应的正反应速率增大的措施是减少A的浓度
D、决定化学反应快慢的主要因素是反应物的性质
第7题:
第8题:
下列关于化学反应与能量变化的叙述中,正确的是
A.人类利用的能量都是通过化学反应获得的
B.在化学反应中只有燃烧反应才能放出热量
C.化学反应过程中都会发生放热现象
D.化学反应伴随有能量变化
第9题:
第10题:
以下关于化学反应速率的论述中,正确的是()