氧化剂
还原剂
催化剂
第1题:
2)步骤二中发生反应的化学方程式是_____,该反应___________(填“是”或“不是”)步骤一中反应的逆反应。

第2题:
停炉保护中,满水保护法常采用 ________ 、N2H4法、氨液法,干法保护常采用 ________ 、充N2法、干燥剂法。
第3题:
第4题:
已知:2NO+2H2=N2+2H2O,当反应容器体积增大一倍,其反应速度为原来的1/8,则该反应为()级反应
第5题:
给水进行N2H4处理的目的是什么?
第6题:
第7题:
锅炉清洗中常用的漂洗剂是 ________ ,漂洗后常用的钝化方法有NaNO2法、N2H4法、 ________法三种。
第8题:
(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H2与N2O4反应能放出大量的热。
(1)已知:2NO2(g)=====N2O4(g) ΔH=-57.20 Kj·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00 g N2H4(1)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出
19.14 kJ的热量。则反应2N2H4(l)+N2O4(l)======3N2(g)+4H2O(l)的ΔH=
▲ kJ·mol-1。
(3)17℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2为混合气体(17℃、1.01*105 Pa),理论上至少需消耗Cu多少克?

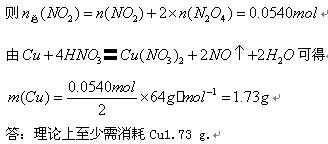
第9题:
N2H4+O2=N2+2H2O的反应中,N2H4是()。
A氧化剂
B还原剂
C催化剂
第10题:
测给水N2H4应用()法,测停炉保护水N2H4应用()法。