对
错
第1题:
同离子效应可降低沉淀的溶解度,所以在AgCl中加入过量的HCl有助于减小AgCl的溶解损失。()
第2题:
第3题:
A、同离子效应
B、同离子效应和盐效应
C、盐效应
D、降低溶液中Ac-浓度
第4题:
 的变化是:
的变化是:
第5题:
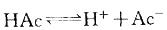 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: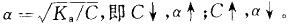 。
。第6题:
在1mol/L的HAc溶液中,欲使H+浓度增大,可采取下列何种方法( )。
A.加水;
B.加NaAc;
C.加NaOH;
D.加0.1mol/L HCl溶液
第7题:
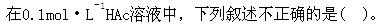
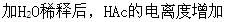
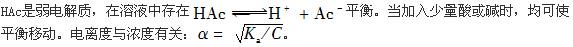
第8题:
此题为判断题(对,错)。
第9题:
第10题:
当沉淀反应达平衡时,向溶液中加入含有构晶离子的试剂或溶液,使沉淀溶解度降低的现象称为()。