第1题:
将0.20摩尔氢氧化钠和0.20摩尔硝酸铵溶于足量水中,使溶液最后的体积为1.0升,问此时溶液的PH值为多少? Kb=1.79×10-5
第2题:
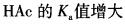
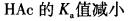
第3题:
A、2.19
B、11.81
C、4.38
D、9.62
第4题:
将0.10mol·L-1的NaAc溶液加水稀释一倍,溶液的pH值变小。
第5题:
往100毫升1.0摩尔/升HAc和1.0摩尔/升NaAc缓冲溶液中,分别加入1.0毫升6.0摩尔/升HCl和1.0毫升6.0摩尔/升NaOH,问溶液的PH值各为多少?(pKa=4.74)
第6题:
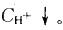
第7题:
在相同温度时,下列水溶液中PH值最小的为()
第8题:
A、NaAc溶液(Ka=1.76×10-5)
B、NH₃H₂O溶液(Kb=1.78×10-5)
C、K₂S溶液(K₂=7.1×10-15)
D、HCN溶液(Ka=4.0×10-10)
第9题:
用等体积C(HAc)=0.20摩尔/升和C(NaAc)=0.60摩尔/升溶液配制成的缓冲溶液,其pH值为多少?(pKHAc=4.74,KHAc=1.8310-5)
第10题:
在298K100ml 0.10mol/L HAc溶液中,加入1克NaAc后,溶液的pH值()。