容积的拉平效应
酸效应
盐效应
溶剂的区分效应
第1题:
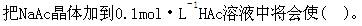

第2题:
在HAc-NaAc的混合液中,HAc和NaAc的浓度都为0.1mol/L,HAc的Ka=1.8×10-5。此缓冲溶液的pH值为()。
A4.74
B7.56
C8.86
D9.26
第3题:
A.酸性
B.碱性
C.中性
D.无法判断
第4题:
已知HCl和HAc的水溶液Ka值分别为Ka≥1和Ka=1.7×10-5,产生这种差别的原因是()
第5题:
0.1mol/L的HCl和0.1mol/L的HAc(Ka=1.8×10-5)等体积混合后pH=()
第6题:
第7题:
有一混合酸溶液,其中HF的浓度为1.0mol/L,HAc的浓度为0.10mol/L,求溶液中H+,F-,Ac-,HF和HAc的浓度已知:Ka(HF)=3.53×10-4 Ka(HAc)=1.76×10-5
第8题:
某弱酸HAc的Ka=1(×)10-5,则其0.1mol/L溶液的PH值为:()?
A.1.0
B.2.0
C.3.0
D.3.5
E.5.0
答案:C
解析:因为是弱酸,所以HAc电离能力很弱,HAc浓度近似等于0.1mol/L,由Ka=【H+】*【Ac-】/【HAc】,【H+】和【Ac-】近似相等,可得【H+】=10-3,PH=-lg(氢离子浓度)所以PH值=3
第9题:
配制pH=7的缓冲溶液时,选择最合适的缓冲对是()。[Ka(HAc)=1.8×10-5,Kb(NH3)=1.8×10-5,H2CO3Ka1=4.2×10-7,Ka2=5.6×10-11,H3PO4Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13]()
第10题:
0.1mol/l的HCl溶液和0.1mol/l的HAc(Ka=1.8×10-5),溶液等体积混合后,pH值为()。