第1题:
有浓度为90%的硫酸溶液100千克,浓度为10%的硫酸溶液500千克,现使用这两种硫酸最多能配成浓度为30%的硫酸溶液多少千克?
A.600
B.500
C.400
D.300
第2题:
第3题:
第4题:
在5mL未知浓度的硫酸溶液中加入95mL水,用0.1mol/LNaOH标准溶液滴定时耗去28.6mL,问硫酸的物质的量c(1/2H2SO4)的浓度等于多少?
第5题:
用140克95%的硫酸和174克15%的硫酸混和后所得溶液的百分比浓度是多少?
第6题:
在5mL未知浓度的硫酸溶液中加入95mL水,用0.1mol/LNaOH标准溶液滴定时耗去28.6mL,问硫酸的物质的量C 的浓度等于多少?
的浓度等于多少?
第7题:
0.025mmol/L硫酸10毫升与0.01mmol/L氢氧化钠20毫升混和,混和后溶液PH是()。
第8题:
取甲种硫酸300克和乙种硫酸250克,再加水200克,可混合成浓度为50%的硫酸;而取甲种硫酸200克和乙种硫酸150克,再加上纯硫酸200克,可混合成浓度为80%的硫酸。那么,甲、乙两种硫酸的浓度各是多少? A.75%,60% B.68%,63% C.71%,73% D.59%,65%
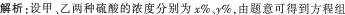

第9题:
把140克95%的硫酸和174克15%的硫酸混合后求混合后的质量百分比浓度。
第10题:
95%的硫酸的干燥效果比98%的硫酸的好,所以干燥塔用95%的硫酸干燥。