A、增大
B、减小
C、不变
D、无法判断
此题为判断题(对,错)。
A、MnO4-与Fe2+
B、MnO4-与Fe3+
C、Mn2+与Fe2
D、Mn2+与Fe3+
以电对MnO4-/Mn2+与Fe3+/Fe2+组成原电池,已知Φθ(MnO4-/Mn2+)Φθ(Fe3+/Fe2+),则反应物是MnO4-与Fe2+。()
1 基础化学第七章 氧化还原反应 习题答案 1. 将下列氧化还原反应设计成原电池,写出电极反应及电池符号: 答 : ( 1) Fe2+ + Ag+ Fe3+ + Ag 电极反应 : 正极 : Ag+ + e- Ag 还原反应 : 负极 : Fe2+ e- Fe3+ 氧化反应 电池符号为 : ( ) Pt | Fe3+ (c1) , Fe2+ (c2) | Ag+ (c3) | Ag (+) ( 2) MnO4- + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O 电极反应: 正极 : MnO4- + 8H+ + 5e- Mn2+ + 4H2O 还原反应 负极 : Fe2+ e- Fe3+ 氧化反应 电池符号为 : ( ) Pt | Fe3+ (c1) , Fe2+ (c2) | MnO4- (c3) , Mn2+(c4) | Pt (+) 2判断下列每一组中较强的氧化剂和较强的还原剂(均为标准状态): 答:( 1) 强氧化剂: Br2, 强还原剂: I-; ( 2) 强氧化剂: Ag+, 强还原剂: Zn; ( 3) 强氧化剂: Cr2O72-, 强还原剂: Fe2+;( 4) 强氧化剂: Sn2+, 强还原剂: Mg。 3根据标准电极电势排列下列氧化剂和还原剂的强弱顺序: 答:氧化剂的氧化能力: MnO4- Cr2O72- Hg2+ Fe2+ Zn2+; 还原剂的还原能力: Sn Fe2+ Ag Cl-。 4 根据 o值判断下列氧化还原反应自发进行的方向 ( 设各物质的 浓度 均为 1 molL-1) 。 ( 1) 2Ag Zn2+ Zn 2Ag+ 解 : o (Ag+/Ag) 0.7996( V) o (Zn2+/Zn) 0.7618( V) Eo o+ o- o (Zn2+/Zn) o (Ag+/Ag) 0.7618V 0.7996V 1.5614V Eo 0, 反应正向进行。 5 有一含 Br 、 I 的混合液,选择一种氧化剂只氧化 I 为 I2,而不氧化 Br ,问应选择 FeCl3 还是 K2Cr2O7? 解 : o(Br2/Br-) 1.065( V) , o(I2/I-) 0.5355( V) , o(Fe3+/Fe2+) 0.771( V) , o(Cr2O72 /Cr3+) 1.232 ( V) 因 o(Cr2O72 /Cr3+) o(Br2/Br-), o(Cr2O72 /Cr3+) o(I2/I-), Cr2O72 既能氧化 Br 又能氧化 I , 故 K2Cr2O7不能选用。而 o(Br2/Br-) o(Fe3+/Fe2+) o(I2/I-), Fe3+不能氧化 Br 但能氧化 I , 故应选 择 FeCl3作氧化剂。 6 在标准状态下,由下列电对组成电池。试确定正、负极,写出电池符号、电极反应和电池反应式 , 并求出电池的电动势 。 ( 1) Cu2+ / Cu+和 Fe3+ / Fe2+ o (Cu2+/ Cu+) 0.153( V) o (Fe3+/ Fe2+) 0.771( V) Eo o+ o- o (Fe3+/ Fe2+) o (Cu2+/ Cu+) 0.771V 0.153V 0.618V 电极反应式: 正极: Fe3+ e- Fe2+ 负极: Cu+ e- Cu2+ 电池反应: Fe3+ Cu+ Fe2+ Cu2+ 电池符号: () Pt (s) | Cu2+ , Cu+ | Fe2+, Fe3+ | Pt (s) () ( 2) AgCl / Ag, Cl-和 Hg2+ / Hg o (AgCl/ Ag) 0.22233( V) o (Hg2+/ Hg) 0.851( V) Eo o+ o- o (Hg2+/ Hg) o (AgCl/ Ag) 3 0.851V 0.22233V 0.629V 电极反应式: 正极: Hg2+ 2e- Hg 负极: Ag + Cl- e- AgCl 电池反应: Hg2+ 2Ag + 2Cl- Hg AgCl 电池符号: () Ag (s)| AgCl, Cl- | Hg2+| Hg (s) () 7 计算 298.15 K 时下列电极的电极电势 : ( 1) Pt(s) | Fe3+ (0.100 molL-1),Fe2+( 0.010 molL-1) 解 : Fe3+ e- Fe2+ ( 2) Ag(s) | AgBr(s) | Br-( 0.100 molL-1) 解: AgBr e- Ag + Br- 8 浓度均为 1.00 molL-1的 KI 与 FeCl3溶液能否共存? 解 : 2Fe3+ 2I- 2Fe2+ I2 Eo o+ o- o (Fe3+ / Fe2+) o (I2/ I-) 0.771V 0.5355V 0.2355V Eo 0, 反应正向自发进行,故 KI 与 FeCl3溶液 不 能共存 。 9 求 298.15 K 时反应 Pb 2Ag+ Pb2+ 2Ag 的 标准 平衡常数。 解: 3 32 32 2 ( F e )0 . 0 5 9 1 6 V( F e /F e ) = ( F e /F e ) + l g n ( F e ) 0 . 0 5 9 1 6 V 0 . 1 0 00 . 7 7 1 V l g 1 0 . 0 1 0 0 . 8 3 0 V r r c c - 0 . 0 5 9 1 6 V 1( A g B r /A g ) = ( A g B r /A g ) + l g 1 ( B r ) 0 . 0 5 9 1 6 V 10 . 0 7 1 1 6 V l g 1 0 . 1 0 0 0 . 1 3 0 V rc + 2+ ( A g /A g ) ( Pb /Pb ) lg 0 .0 5 9 1 6 V 2 ( 0 .7 9 9 6 V 0 .1 2 6 2 V ) 0 .0 5 9 1 6 V 3 1 .3 0 nK 4 Ko 1.9951031 10用玻璃电极与饱和甘汞电极插入 pHs = 3.57 的标准缓冲溶液中,组成电池,在 298.15 K 时测得 其电动势 Es = 0.0954 V。再将溶液换成未知 pHx 值的溶液组成电池, 298.15 K 时测得其电动势 Ex = 0.340 V,求待测溶液的 pH。 解: 11若 Pt | H2( 100 kPa),胃液 | KCl( 0.1 molL-1), Hg2Cl2| Hg 的电 动势等、于 0.420 V,而 Pt | H2( 100 kPa) H+( 1.0 molL-1) | KCl( 0.1 molL-1), Hg2Cl2 | Hg 的电动势等于 0.334 V,求胃液的 pH。 解:对于电池: Pt | H2( 100 kPa) H+( 1.0 molL-1) | KCl( 0.1 molL-1), Hg2Cl2 | Hg E1 + oSHE + 0.334 ( V) 对于电池: Pt | H2( 100 kPa),胃液 | KCl( 0.1 molL-1), Hg2Cl2| Hg E2 + 待测 0.334 待测 0.420( V) 待测 0.086( V) 根据能斯特方程 2+ + 2 ( H )0 .0 5 9 1 6 V= ( H /H ) + l g 2 1 0 0 /1 0 0 0 .0 5 9 1 6 V p H 0 .0 8 6 V rc 待 测
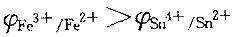 ;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
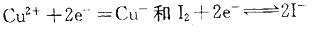 ,离子浓度升髙,它们的电极电势增加
,离子浓度升髙,它们的电极电势增加
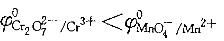 ,所以氧化性的强弱为MnO4- >Cr2O72-
,所以氧化性的强弱为MnO4- >Cr2O72-
 能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
 B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-