已知某元素+2价离子的核外电子排布式为:[Ar]3d5,该元素在周期表中处于()周期、()族、()区,元素符号是()。
第1题:

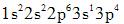


第2题:
第3题:
第4题:
某离子M3+的电子排布式为[Ar]d6,则该元素属于()族。
第5题:
某元素最高正价与负价绝对值之差为4,该元素的离子与跟其核外电子排列相同的离子形成的化合物是()
第6题:
第7题:
第8题:
第9题:
已知A、B、C、D和E5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:组成A分子的原子的核外电子排布式是()
第10题:
已知某副族元素A的原子,电子最后排入3d,最高氧化数为+4;元素B的原子,电子最后排入4p,最高氧化数为+5。回答下列问题: ⑴写出A、B元素原子的核外电子排布式。 ⑵根据核外电子排布式,指出它们在周期表中的位置(周期、族)。