写出29号元素原子基态电子的排布式?
第1题:
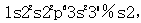 ,c项描述的不是同种元素的原子;D项.最外层电子数是核外电子总数的1/5的原子是Br,其核外电子排布为 )
,c项描述的不是同种元素的原子;D项.最外层电子数是核外电子总数的1/5的原子是Br,其核外电子排布为 )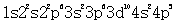 .D项描述的不是同一种元素的原子;故本题选A。
.D项描述的不是同一种元素的原子;故本题选A。第2题:
写出原子序数为24的元素的名称,符号及其基态原子的电子排布式,并用四个量子数分别表示每个价电子的运动状态。
第3题:
(6分)下列元素基态原子的电子排布式是否正确?若不正确,违背了什么原理?请写出正确的电子排布式。
(1) Li:1s22p1
(2) A1:ls22s22p63s3
(3) N:ls22s22px22py1

第4题:
某元素基态原子最外层为5s2,最高氧化态为+4,它位于周期表哪个区?是第几周期第几族元素?写出它的+4氧化态离子的电子构型。若用A代替它的元素符号,写出相应氧化物的化学式。
第5题:
写出原子序数分别为33.52.74三种元素原子的电子排布,并判断它们在周期表中的位置(区.周期.族)及元素名称
第6题:
简述电子在原子核外排布的规则,并写出N、Cu的核外电子排布式。
第7题:
若推导基态原子电子组态的构造原理对未合成的重元素仍然适合,请问:第八周期的最后一个元素的原子序数多大?请写出它的基态原子的电子组态。
第8题:
第9题:
某元素的基态价层电子构型为5d66s2,请给出比该元素的原子序数小4的元素的基态原子电子组态。
第10题:
若某基态原子的外围电子排布为4d15s2,则下列说法正确的是()