某短周期非金属元素的核外最外层电子数是次外层电子数的一半,该元素()。
第1题:
第2题:
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z元素的原子M层电子数是L层电子数的一半,W元素可形成自然界最硬的原子晶体。下列叙述错误的是()。
第3题:
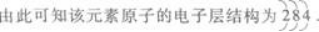
第4题:
某元素的价电子为4s24p4,问:它的最外层、次外层的电子数;它的可能氧化态,它在周期表中的位置(周期、族、区),它的基态原子的未成对电子数,它的氢化物的立体结构。
第5题:
主族元素的性质主要由其原子的最外层电子数和电子层数决定,若元素的最外层电子数为m,电子层数为n,一般具有这样的规律:m>n的元素为非金属元素;m≤n的元素为金属元素。下列推断符合实际的有()
第6题:
元素周期表中元素的周期序数与原子的()相同。
第7题:
某元素的原子核外有三层电子层,最外层电子数是核外电子数的1/6,该元素的元素符号是Mg。
第8题:
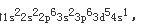
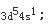
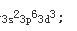
第9题:
某元素最高氧化数为+6,最外层电子数为1,原子半径是同族元素中最小的。下列叙述中哪一个不正确()?
第10题:
元素周期表与原子结构关系()。