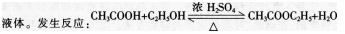(1)问题1可以得到以下信息:
①甲烷、氯气要用排饱和食盐水的方法收集:
②光照会影响氯气与甲烷反应。
问题2可以得到以下结论:
①甲烷、氯气在饱和食盐水中的溶解度很低:
②氯气与甲烷在光照条件下反应,需要避免日光照射。否则会引起爆炸。
(2)一、教学目标
知识与技能:掌握甲烷的取代反应。
过程与方法:通过甲烷与氯气反应现象的探究,学习观察现象。帮助学生理解反应事实的方法。
情感态度与价值观:在课堂探究过程中,感受科学方法在化学学习及研究中的重要作用.培养严谨求实的科学态度。
二、教学方法
讲演结合、自学引导
三、教学过程
环节一:温故知新.导入新课
教师提问:
问题1:请用分子式、电子式、结构式分别表示出甲烷。
问题2:前一节课中,学习了甲烷具有怎样的化学性质,可以发生什么反应,请用化学反应方程式表示出来。
学生思考,并写出甲烷的分子式、电子式、结构式,甲烷与氧气反应的化学反应方程式。

评价学生的回答情况。
过渡:甲烷的化学性质比较稳定,除了与性质活泼的氧气发生氧化反应以外。如果遇到活泼的氯气.会发生怎样的变化呢?
环节二:讲演结合、讲授新课
【板书】甲烷的取代反应
教师引导:下面。请同学们认真观察老师的演示实验。
【实验】取2个100mL的量筒,第1个量筒用排饱和食盐水的方法收集20mLCH4和80mLCl2,用黑袋套住.观察发生的现象。
第2个量筒用排饱和食盐水的方法收集20mLCH4和80mLCl2,放在光亮的地方,日光不要直射,等待片刻.观察发生的现象。
学生观察,并描述实验现象:第1个量筒没有变化,第2个量筒壁上出现油滴,量筒内的液面上升,气体颜色微变浅.并析出白色晶体。
教师引导:这说明它们之间发生了怎样的变化?这个过程中如果有新物质生成.可能生成了什么物质?请大家讨论回答并说出你的理由.
学生讨论并回答:氯气参加反应,因而逐渐减少,黄绿色逐渐变浅,液面上升,油状物质是新生成的物质,分子式中应该合有氯原子,还可能生成氯化氢,可以用pH试纸验证。
教师用pH试纸验证,得出pH试纸变红的现象。
教师引导:生成氯化氢.那么另一种生成物的化学式应该怎样书写?请大家试着写出来。

教师讲述:像甲烷这样.有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫作取代反应。一取代产物称为一氯甲烷。实际上,甲烷分子里的氢原子是被氯原子逐步取代的,请大家依次写出其他的反应产物。
学生书写:

环节三:动画演示.巩固提高
【多媒体】动画演示甲烷的取代反应就是甲烷分子中处于四个顶点的氢原子逐个被氯原子取代,生成氯代甲烷的过程。
教师:请同学们思考取代反应与以前学过的什么反应类型有相似之处?它们有什么区别?
学生思考并回答:与置换反应有相似之处。
置换反应与取代反应的区别:
(1)取代反应不一定有单质参加或生成;而置换反应中一定有单质参加或生成;
(2)取代反应是有机反应,能否进行,一般受温度、光照、催化剂等影响较大;而置换反应是无机反应,与这些条件的关系并不十分明显:
(3)取代反应逐步进行,一般都为可逆的。
环节四:小结作业.结束课堂
师生总结本节的学习历程及主要知识点。